インドール環隣接炭素上での超高速求核置換反応の開発
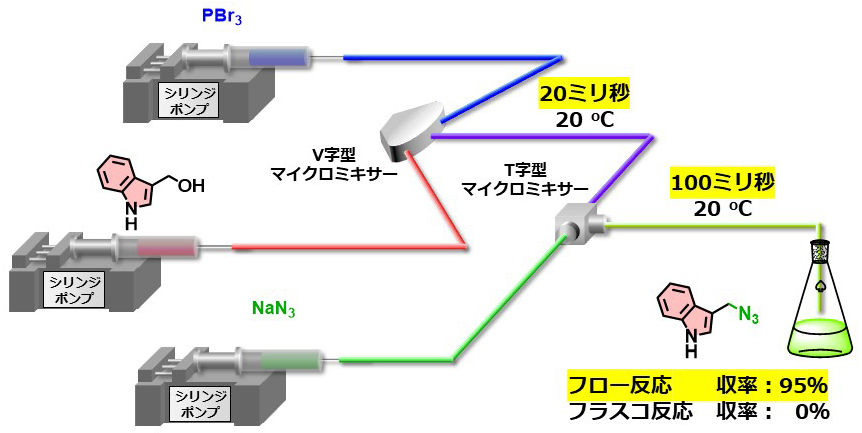
インドール環は承認されている医薬品に含まれる351の環構造の中で、13番目に多く見られるため、インドール誘導体を効率的に合成する手法は創薬において極めて重要です。また、米国の製薬会社から出願された特許において掲載された合成反応をビックデータ解析した報告によると、過去40年間で最も多く利用された反応はヘテロ原子のアルキル化反応です。もしもヘテロ原子のアルキル化反応をインドール環に隣接する炭素上で進行させられれば、多様なインドール誘導体を簡便に合成できるものと期待されるますが、電子豊富なインドールは反応過程で望まない二量化や多量化を容易に速やかに起こすため、目的物を高収率で得ることはこれまで容易ではありませんでした。私たちはマイクロフロー合成法の利点を生かして、インドール化合物を20ミリ秒以内に活性化し、生じた活性中間体を100ミリ秒以内でアルキル化反応に用いることで目的物を95%の高収率で得ることに成功しました。本反応は極めて副反応が高速で進行するため、フラスコを用いて本反応を実施したところ、全く目的物は得られませんでした。
Commun. Chem. 6, 47, (2023).
ベンゼン環隣接炭素上での超高速求核置換反応の開発
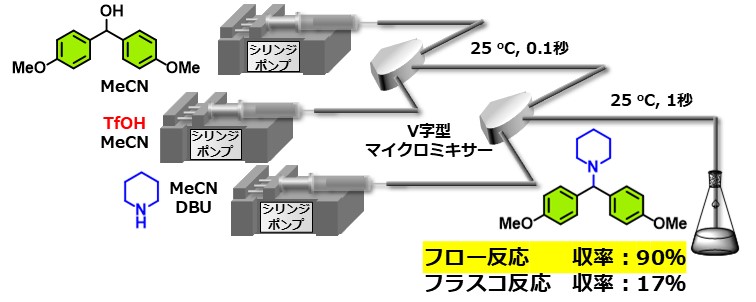
アルコールに酸を作用させて対応するカルボカチオンを生成させて、求核置換反応に用いる手法は有機合成化学における最も基本的な合成手法の一つですが、アルコールの活性化に酸を用いるため、高い塩基性をもつアミンのような求核剤を用いることは困難でした。これは、アミンの求核攻撃に優先してプロトン化による失活が起こるためです。私たちはマイクロフロー合成法の利点を生かして、アルコールを強酸のTfOHにより0.1秒以内に活性化し、生じたカルボカチオンを1秒以内でアミンと反応させることで目的物を高収率で得ることに成功しました。本反応を、フラスコを用いて実施したところ、複数の副反応が競合して目的物の収率は17%にとどまりました。
Chem. Commun. 60, 2497, (2024).
他にも、もっと色々な芳香環隣接炭素上での高速求核置換反応を報告しています!
インドール2位隣接炭素上でのマイクロフロー高速求核置換反応
Synthesis, 56, (17), 2663-2669, (2024).
フラン環隣接炭素上でのマイクロフロー高速求核置換反応
Org. Biomol. Chem. 22, (17), 3448-3452, (2024).
インドール3位隣接炭素上でのマイクロフロー高速求核付加-求核置換連続反応
Chem. Asian J. 19, (1), e202300909, (2024).