ペプチドの合成
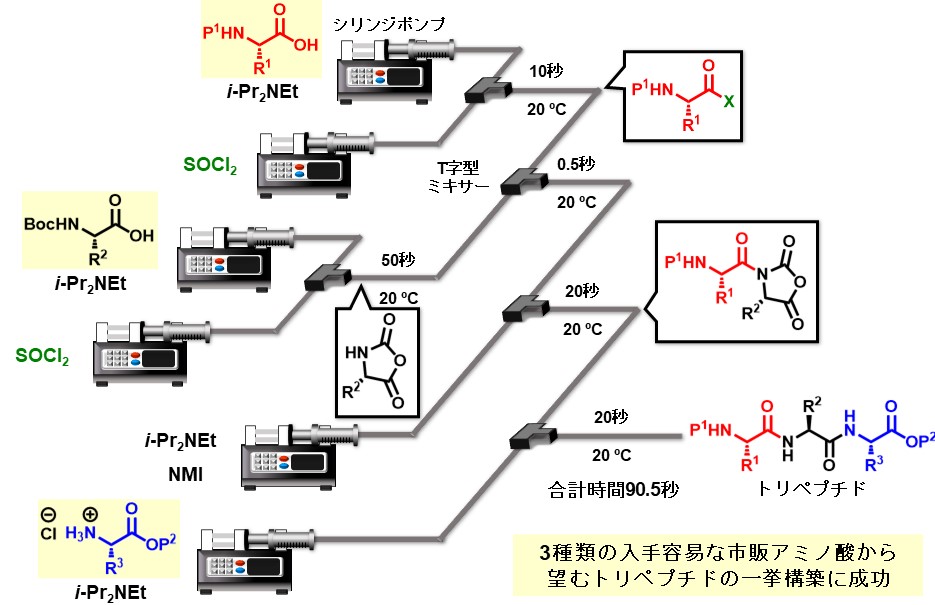
マイクロフロー合成法の応用先の一つとしてペプチドの合成に焦点を当てています。下図に示す通り、ペプチド合成ではこれまで副反応を防ぐために比較的高価で廃棄物を多く出す反応剤を用いる手法が主でした。一方で私達は安価で廃棄物の少ない反応剤を用いてもマイクロフロー合成法で反応時間を数秒未満で精密に制御することでペプチドを収率良く合成できることを報告しています。
Angew. Chem. Int. Ed. 53, (3), 851-855 (2014).
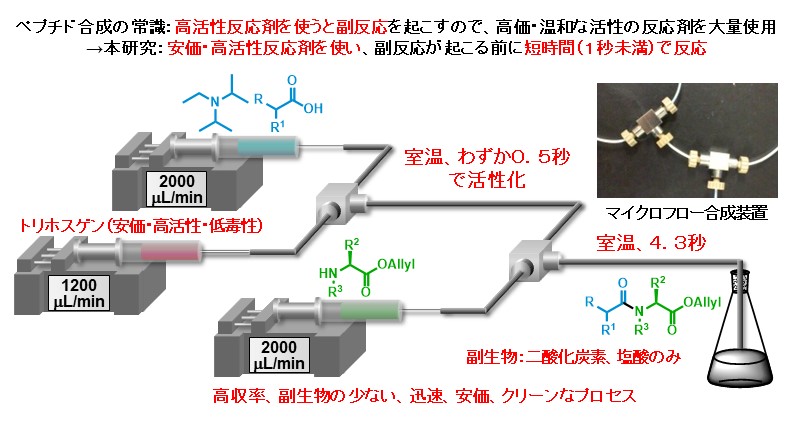
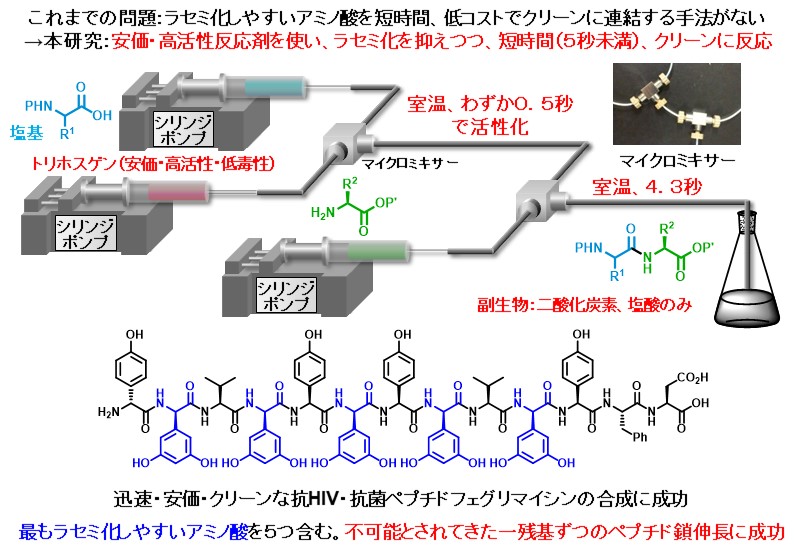
開発した手法を駆使して、抗菌・抗HIV活性をもつ天然由来のペプチドであるフェグリマイシンの全合成を達成しました。ペプチドは通常、カルボン酸末端側から一つずつアミノ酸を連結して合成されますが、この手法によるフェグリマイシンの合成は副反応を誘発するため不可能とされていました。これを可能にした上での成果です。
Nat. Commun. 7, 13491 (2016).
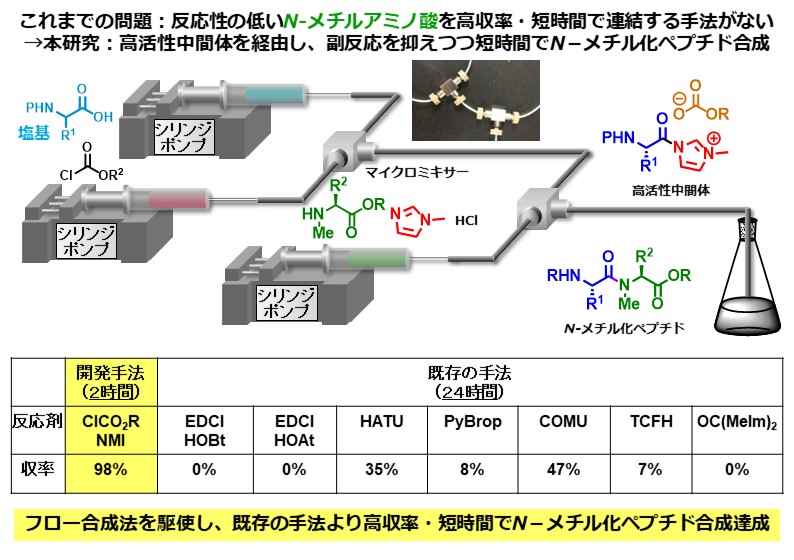
ペプチド結合を構成する窒素原子上にメチル基をもつペプチドはN-メチル化ペプチドと呼ばれ、近年、特殊ペプチド医薬品として注目を集めています。しかしながら、N-メチルアミノ酸の反応性が低いため、その連結は容易ではありません。私達は、アシルN-メチルイミダゾリウムイオンという、とても反応性の高い活性種を用いることでこの問題を解決することに成功しました。また、本反応において酸の添加が劇的に反応を加速するという未知の効果を発見しました。開発した手法は、これまでに報告された、N-メチル化ペプチドの合成に有効とされている様々な手法と比較しても短時間かつ高収率で目的物を与えます。
Angew. Chem. Int. Ed. 59, (31), 12925-12930 (2020).
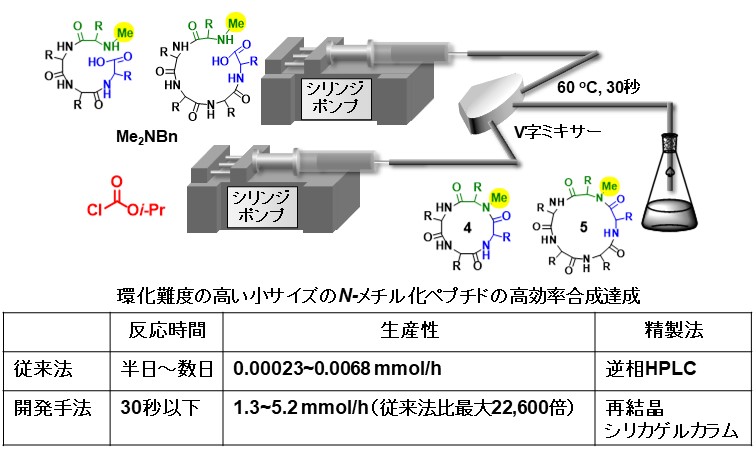
環状のN-メチル化ペプチドは代謝安定性や生体標的分子に対する選択性や親和性が高まり、細胞膜透過や経口投与も可能にすることがあるため、医薬品としての重要性がますます高まっています。しかしながら、鎖状のペプチドを環化するために高価な反応剤を多量に用い、半日~数日もの反応時間を要することが多い点が問題となっていました。特に6つ以下の少数のアミノ酸からなる環状のN-メチル化ペプチドは環化しにくさから合成難度が大変高いのですが、私達はアシアンモニウムイオンを駆使して、低コストで短時間で副反応を抑えつつ、高収率でこれらの環状ペプチドを合成する手法の開発に成功しました。開発した手法では従来法で要していた反応時間を大幅に短縮可能であり、精製操作も簡便化できました。生産性を従来法と比べ最大で22,600倍向上させることに成功しました。
Angew. Chem. Int. Ed. 62, (27), e20230647, (2023).
ペプチド鎖の伸長は保護アミノ酸の連結と脱保護反応を繰り返すため、実に全工程の半分は脱保護工程が占めることとなります。もしも脱保護工程を挟まずに次々とアミノ酸を連結できれば、より短時間に低コストでペプチドを得られます。私達は最近後述するNCAと呼ばれるアミノ酸誘導体を用いて、超高速で脱保護工程を挟まずにペプチド鎖を伸長する手法の開発に成功しました。
Chem. Sci. 14, (25), 6986-6991 (2023).
アミノ酸誘導体の合成
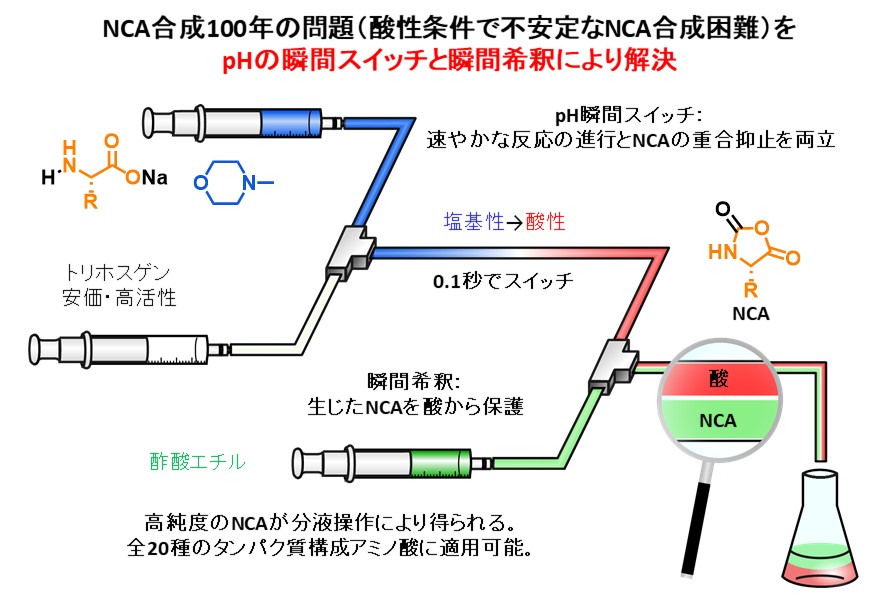
マイクロフロー合成法によりNCAと呼ばれる重要なアミノ酸誘導体の効率合成にも成功しています。下図に示す通り、NCAの合成では酸性条件下で不安定なNCAを合成できない点が100年近くもの間、問題となってきました。塩基性条件下でNCAを調製すれば速やかに目的物は生じるのですが、副反応が引き起こされてしまうことから従来法では強酸性条件下で反応せざるを得ませんでした。私達は塩基性でNCAを合成し、僅か0.1秒以内で酸性にスイッチし、さらに瞬間希釈により温和な酸性条件に調整してNCAを得る革新的な手法の開発に成功しています。
Angew. Chem. Int. Ed. 57, (35), 11389-11393 (2018).
他にも、もっともっと色々なマイクロフローペプチド、アミノ酸誘導体合成法を報告しています!
マイクロフロー合成法により望まない分子内反応を抑えつつペプトイド鎖を伸長
Org. Lett. 26, (48), 10280-10284 (2024).
C末端遊離のN-メチル化ペプチドのマイクロフロー合成。酸無水物のブレンステッド酸による活性化効果の検証や、C末端遊離のN-メチル化ペプチドのエピメリ化も報告
Chem. Eur. J.30, (38), e202401402, (2024).
BocCl等価体のマイクロフロー合成とその利用。Boc保護α-アミノ酸N-カルボキシ無水物のマイクロフロー合成も報告
Org. Process Res. Dev. 28, (5), 1971-1978 (2024).
C,N末端遊離ジペプチドの連結-環化連続反応による環状N-メチル化ペプチドの一挙マイクロフロー合成
Eur. J. Org. Chem. 26, (35), e202300700, (2023).
ウレタン保護α-アミノ酸N-カルボキシ無水物のマイクロフロー合成。アシルアンモニウムイオンやα-アミノ酸N-カルボキシ無水物の安定性も報告
Org. Biomol. Chem. 20, (16), 3303-3310, (2022).
トリホスゲンを用いたマイクロフローペプチド環化
Chem. Eur. J. 27, (27), 7525-7532 (2021).
マイクロフロー迅速両基質活性化によるβ-アミノ酸誘導体の合成
Chem. Commun. 56, 4527-4530 (2020).
β-アミノ酸N-カルボキシ無水物のマイクロフロー合成
Chem. Asian J. 15 (1), 79-84, (2020).
C,N末端遊離アミノ酸を用いたC末端遊離ペプチドのマイクロフロー合成
Chem. Eur. J. 25, (66), 15091-15097, (2019).
光マイクロフロー反応を駆使したペプチド環化
Org. Biomol. Chem. 14, (47), 11244-11249, (2016).
光マイクロフロー反応を駆使した3,5-ジヒドロキシフェニルグリシンの合成
J. Flow. Chem. 4, (4), 173-179, (2014).
反応系内発生ホスゲンを用いたフローアミド結合形成
Chem. Commun. (47), 12661-12663, (2011).